1.3 Compuestos ternarios (hidróxidos y oxoácidos)
Los compuestos ternarios son combinaciones de tres elementos.
Hidróxidos
Los hidróxidos están formados por el grupo OH-, que actúa con número de oxidación -1, y un metal.
Para formular: escribe el símbolo del metal seguido del OH, entre paréntesis, e intercambia los números de oxidación como subíndices sin signo.
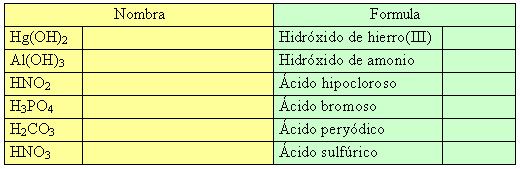
Para nombrar: utiliza el mismo procedimiento que en los compuestos binarios. Empieza con "hidróxido de", seguido del nombre del metal y utiliza los prefijos numerales o el sistema de Stock.
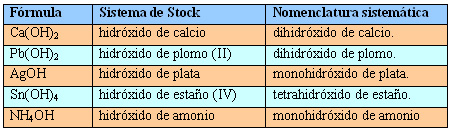
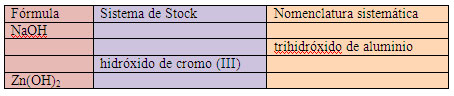
Ejemplo o ejercicio resuelto
Oxoácidos
Resultan de la reacción de un óxido (generalmente de un elemento no metálico) y agua.
CO2 + H2O → H2CO3
N2O3 + H2O → H2N2O4 → HNO2
La fórmula general para un oxoácido es:
HaXbOc
En la nomenclatura tradicional se empieza con la palabra ácido y se sigue con la raíz del elemento utilizando unos prefijos y sufijos que indican la valencia con la que actúa. Esos prefijos y sufijos son per-, -ico, hipo-, -oso.
|
|
|
Número de valencias del elemento X |
|||
|
|
|
1 BORO |
2 NITRÓGENO |
3 CROMO |
4 BROMO |
|
Prefijos y Sufijos |
hipo-oso |
|
|
V=2 Ácido hipocromoso |
V=1 Ácido hipobromoso |
|
-oso |
|
V=3 Ácido nitroso |
V=3 Ácido cromoso |
V=3 Ácido bromoso |
|
|
-ico |
V=3 Ácido bórico |
V=5 Ácido nítrico |
V=6 Ácido crómico |
V=5 Ácido brómico |
|
|
per-ico |
|
|
|
V=7 Ácido perbrómico |
|
El carbono, en el CO2 , utiliza la valencia (IV)
CO2 + H2O → H2CO3 Ácido carbónico
El nitrógeno en el N2O3 utiliza la valencia (III)
N2O3 + H2O → H2N2O4 → HNO2 Ácido nitroso
El nitrógeno en el N2O5 utiliza la valencia (V)
N2O5 + H2O → H2N2O6 → HNO3 Ácido nítrico
Importante:
“El nitrógeno en los oxoácidos sólo utiliza las valencias 3 y 5.”
Mn2O7 + H2O → H2Mn2O8 → HMnO4 Ácido permangánico
Ejercicio
Asigna nombre a los oxoácidos de abajo.
Hay una fórmula con la que se puede calcular la valencia con la que actúa el átomo central:
![]()
Ejemplos:
- Ejemplo 1: Calculemos la valencia con la que actúa el azufre en el H2SO4:
![]()
Como el azufre tiene valencias 2, 4 y 6, estaremos hablando del ácido sulfúrico.
- Ejemplo 2: Calculemos la valencia con la que actúa el azufre en el HNO3:
![]()
Como el nitrógeno tiene valencias 3 y 5, estaremos hablando del ácido nítrico.
- Ejemplo 3: Calculemos la valencia con la que actúa el azufre en el HBrO4:
![]()
Como el bromo tiene valencias 1, 3, 5 y 7, estaremos hablando del ácido perbrómico.
- Ejemplo 4: Averigüemos ahora la valencia del fósforo en el ácido pirofosfórico, H4P2O7:
![]()
Rellena los huecos con el número de la valencia
Utiliza la fórmula anterior para averiguar la valencia del átomo central.
Prefijos meta-, piro-, orto-
Estos prefijos pueden aparecer en algunos oxoácidos (ácido ortofosfórico, ácido metabórico…).
Al óxido se le suman tantas moléculas de agua como indica la siguiente tabla:
|
Valencia del átomo central |
||
|
Prefijo |
Valencia PAR |
Valencia IMPAR |
|
META- |
+ 1 H2O |
+ 1 H2O |
|
PIRO- |
|
+ 2 H2O |
|
ORTO- |
+ 2 H2O |
+ 3 H2O |
Veámoslo mejor con varios ejemplos:
Cuando la valencia con la que actúa es impar:
|
Prefijo |
Moléculas de agua que se suman |
Ejemplo |
|
|
Meta |
+ 1 H2O |
Ácido metafosforoso |
P2O3 + 1 H2O → H2P2O4 → HPO2 |
|
Piro |
+ 2 H2O |
Ácido pirofosfórico |
P2O5 + 2 H2O → H4P2O7 |
|
Orto |
+ 3 H2O |
Ácido ortofosfórico o ácido fosfórico (se suele omitir el prefijo orto-). Igual sucede en el ácido ortobórico o ácido bórico |
P2O5 + 3 H2O → H6P2O8 → H3PO4 |
Cuando la valencia es par:
|
Prefijo |
Moléculas de agua que se suman |
Ejemplo |
|
|
Meta |
+ 1 H2O |
Ácido metasilícico |
SiO2 + 1 H2O → H2SiO3 |
|
Orto |
+ 2 H2O |
Ácido ortosilícico o ácido silícico |
SiO2 + 2 H2O → H4SiO4 |
Existen algunas excepciones a estas reglas:
|
Fórmula |
Nombre aceptado |
Transformación |
Nombre aceptado |
|
|
HIO4 |
ácido peryódico |
H5IO6 |
ácido ortoperyódico (+5H2O) |
|
|
H2TeO4 |
ácido telúrico |
H6TeO6 |
ácido ortotelúrico (+3H2O) |
|
|
Fórmula |
Nombre aceptado |
Transformación |
Nombre aceptado |
|
|
HBO2 |
ácido metabórico |
H3BO3 |
ác. bórico = ác. ortobórico |
|
|
H2SiO3 |
ácido metasilícico |
H4SiO4 |
ác. silícico = ác. ortosilícico |
|
|
HPO3 |
ácido metafosfórico |
H3PO4 H3PO3 |
ác. fosfórico (P→As,Sb) = ác. ortofosfórico ác. fosforoso = ác. ortofosforoso |
|
Rellenar huecos
Escribe la correspondiente fórmula:
Prefijos di-, tri-
Multiplicamos el ácido por el número que indica el prefijo y restamos una unidad menos de agua.
|
Prefijo |
¿Qué hacer? |
|
DI- |
x 2 – 1 H2O |
|
TRI- |
x 3 – 2 H2O |
Ejemplo:
Acido dicrómico
Primero formulamos el ácido crómico y después lo multiplicamos por dos y restamos una molécula de agua.
CrO3 + H2O → H2CrO4 ; 2·( H2CrO4) – 1 H2O → H2Cr2O7
Ácido trifosfórico P2O5 + 3 H2O → H3PO4 ; 3·(H3PO4) – 2 H2O → H5P3O10
|
Fórmula |
Nombre aceptado |
Transformación |
Nombre aceptado |
|
H4SiO4 |
ácido silícico |
H6SiO7 |
ácido disilícico |
|
H3PO4 |
ácido fosfórico |
H4P2O7 |
ácido difosfórico |
|
H2SO4 |
Ácido sulfúrico |
H2S2O7 |
Ácido disulfúrico |
Importante:
Los ácidos con el prefijo piro- se formulan como los di-ácidos. Así, el ácido pirosulfúrico se formula como el ácido disulfúrico.
Ácido disulfúrico SO3 + H2O → H2SO4; 2·(H2SO4) – 1 H2O → H2S2O7
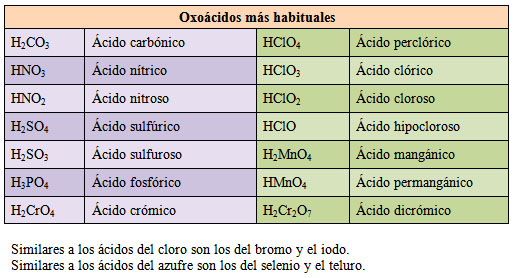
Oxoácidos más habituales:
Ejercicios
Formula o nombra: