Espontaneidad
Existen procesos en la naturaleza que son espontáneos (tienden a darse):
Ejemplos:
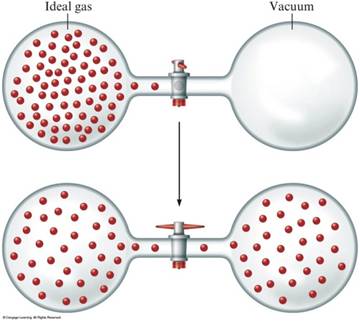
La expansión de un gas frente al vacío.
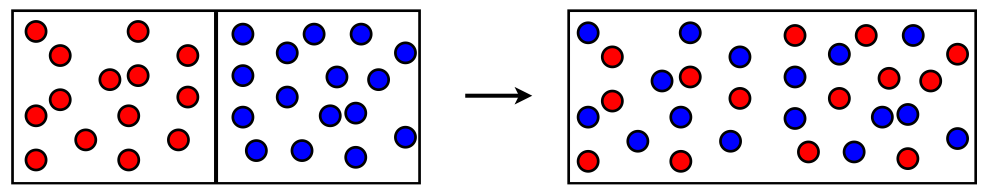
La mezcla de dos gases inicialmente separados.
La disolución de un soluto.

La igualación de temperaturas entre dos cuerpos que se ponen en contacto.
La reacción entre una lámina de cinc y el ácido clorhídrico (se forma cloruro de cinc y se desprende hidrógeno).

En todos estos procesos espontáneos, el sistema evoluciona hasta alcanzar un estado de equilibrio, y experimentalmente se sabe que, una vez alcanzado éste, el sistema no evoluciona en sentido contrario, es decir, no tiende a apartarse del estado de equilibrio: para que el sistema evolucione es necesario el aporte de una energía exterior.
El hecho de que un sistema evolucione en un sentido determinado no significa que la reacción sea rápida. Por ejemplo, la oxidación de un clavo es muy lenta, y solo se produce espontáneamente en el sentido de reacción del hierro con oxígeno, no en el de descomposición del óxido para formar hierro y oxígeno.
¿Qué relación tiene este hecho en las reacciones químicas? Según la experiencia, la gran mayoría de los procesos espontáneos son exotérmicos (∆H<0)
Luego, podríamos decir que una reacción será espontánea si es exotérmica, ∆H<0.
Sin embargo, hay procesos físicos y químicos que se producen espontáneamente siendo endotérmicos.
Un ejemplo muy conocido son las bolsas que se utilizan cuando se producen lesiones deportivas para evitar inflamaciones, y que al mezclar sus componentes se ponen a muy baja temperatura: el proceso es espontáneo, pero endotérmico.

Otras reacciones endotérmicas y espontáneas son:
NH4Cl(s) → NH4+(aq) + Cl– (aq) ∆Ho = 14,7 kJ
H2O(l) → H2O(g) ∆Ho = 44,0 kJ

Todo proceso que esté en consonancia con este principio tendrá muchas posibilidades de que tienda a darse y, por tanto, de ser espontáneo.
CaCO3(g) + 2HCl(ac) → CaCl2(ac) + H2O(l) + CO2(g)
Obra publicada con Licencia Creative Commons Reconocimiento Compartir igual 4.0