Relación entre Qp y Qv
Teniendo en cuenta que
Qv=∆U
Qp=∆H
Y, de acuerdo con la definición de entalpía
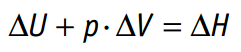
Entonces podemos escribir:
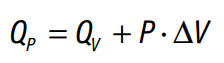
Si consideramos que la variación de volumen en los reactivos y de los productos es despreciable en el caso de compuestos sólidos y líquidos, y solo es importante en el caso de los gases y teniendo en cuenta la ecuación de estado de los gases (p·V=n·R·T), entonces:
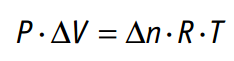
Y sustituyendo en la ecuación anterior nos queda:
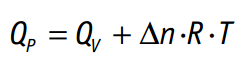
siendo ∆n = nº de moles de los productos (gases) menos el nº de moles de los reactivos (gases).
Obra publicada con Licencia Creative Commons Reconocimiento Compartir igual 4.0