Mediante las Energías de Enlace
Procedimiento 2:
Otra forma de calcular la entalpía de una reacción es a partir de las energías de enlace.
Así tenemos que:
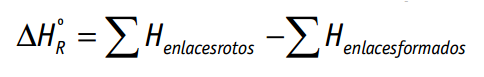
La reacción es:
CH2=CH2(g) + H2(g) → CH3–CH3(g)
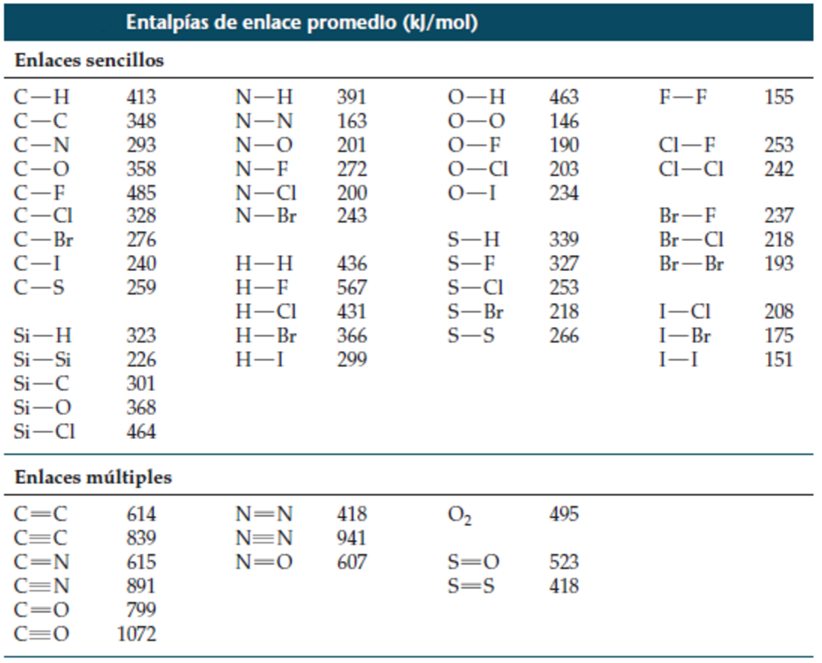
En el proceso se rompe un enlace C=C y otro H–H y se forman 2 enlaces C–H nuevos (el etano tiene 6 mientras que el eteno tenía sólo 4) y un enlace C–C.
∆Ho = ∑ Ee(enl. rotos) – ∑ Ee(enl. formados) =
=1xEe(C=C) + 1xEe(H–H) – 1xEe(C–C) – 2xEe(C–H)=
=1 mol · 614 kJ/mol + 1mol x 436 kJ/mol – 1 mol x 348 kJ/mol – 2 mol x 413 kJ/mol = –124 kJ/mol
La reacción de disociación del HCl será:
(4) HCl(g) → H(g) + Cl(g) ∆Ho = ?
∆Ho (1)= ∑ Ee(enl. rotos) – ∑ Ee(enl. formados)
∆Ho (1)=1/2·Ee(H-H) + 1/2·Ee(Cl-Cl) – 1·Ee(H–Cl) =
–92,3 kJ = + ½ x(436,0 kJ) + ½ x (243,4 kJ) - ∆Ho(4)
∆Ho(4)= 432,0 kJ/mol
Obra publicada con Licencia Creative Commons Reconocimiento Compartir igual 4.0