Mediante Entalpías de Formación
Procedimiento 1: Mediante las entalpías de formación.
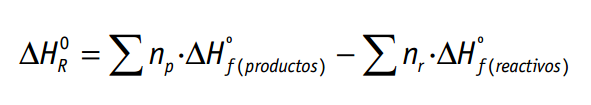
donde np son los coeficientes estequiométricos de los productos y nr de los reactivos.
∆Hof es la variación de entalpía estándar de formación que es la variación de energía que resulta en la formación de un mol de un compuesto a partir de sus elementos también en condiciones estándar.
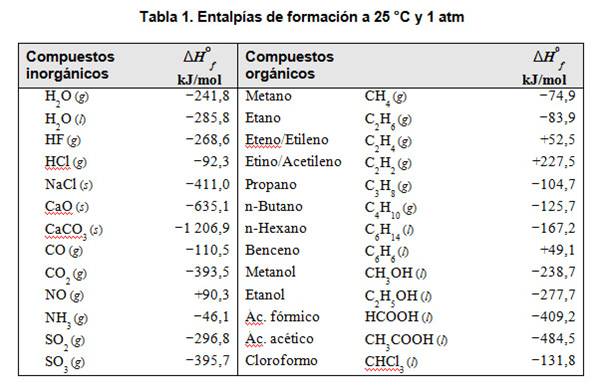
Estos valores están tabulados.
Por lógica, la entalpía estándar de formación de los elementos es cero:
ΔHfO2(g)=0; ΔHfFe(s)=0; ΔHfH2(g)=0, etc
Luego:
ΔHfCO2(g) = HCO2(g)
C(s) + O2(g) → CO2(g); ∆Hof = – 393,5 kJ/mol
H2(g) + ½ O2(g) → H2O(l); ∆Hof = – 285,8 kJ/mol
H2(g) + ½ O2(g) → H2O(g) ; ∆Hof= –241,8 kJ/mol
1/2H2(g) + 1/2Cl2(g) → HCl(g) ; ∆Hof = -92,3 kJ/mol
Ca(s) + C(s)+ 3/2O2(g) →CaCO3(s); ∆Hof = -1206,9 kJ/mol
La reacción de combustión del butano es:
C4H10(g) +13/2O2(g) → 4 CO2(g) + 5H2O(l) ; ∆Ho= ?
ΔH0 = Σ npΔHof(productos) – Σ nrΔHof(reactivos) =
=4 mol·(–393,5 kJ/mol) + 5 mol·(–285,8 kJ/mol) –1 mol·(–24,7 kJ/mol) = –2878,3 kJ
Luego la entalpía estándar de combustión será:
∆Ho= –2878,3 kJ/mol
Obra publicada con Licencia Creative Commons Reconocimiento Compartir igual 4.0