Mediante la Ley de Hess
«La variación de entalpía, ΔH, en una reacción química es la misma si la reacción se realiza directamente en una sola etapa, o bien se realiza en varias etapas».
Esta ley es consecuencia de que la entalpía es función de estado, y su variación sólo depende del estado inicial y final y no del camino por donde transcurre la reacción.
Como consecuencia de esta ley las ecuaciones químicas se pueden tratar como si fuesen ecuaciones algebraicas y se podrán realizar sumas, restas, productos y divisiones, lo mismo con los calores de reacción.
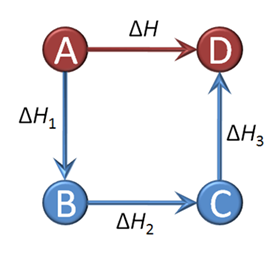
A→D ∆H=¿?
A → B ∆H1
B → C ∆H2
C → D ∆H3
A+B+C → B+C+D = A → D
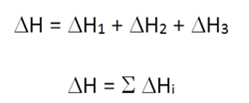
Ejemplo: Calcula el valor de la entalpía de la reacción de hidrogenación del etileno para dar etano, sabiendo que las entalpías de combustión del hidrógeno, el etileno y el etano son, respectivamente, de -286 kJ/mol, -1410 kJ/mol y - 2217 kJ/mol.
La reacción de la que queremos determinar su entalpía es:
CH2=CH2 + H2 →CH3-CH3; ∆HR=¿?
Y disponemos de los siguientes datos:
(a) H2 + 1/2O2 → H2O; ∆H =-286 kJ/mol
(b) CH2=CH2 + 3O2 →2CO2 + 2H2O; ∆H= -1410 kJ/mol
(c) CH3-CH3 + 7/2 O2 →2CO2 + 3H2O; ∆H= -2217 kJ/mol
Si sumamos las reacciones (a)+(b)-(c) obtendremos la ecuación principal.
Aplicando la ley de Hess,
ΔHR = ΔH(a) + ΔH(b) - ΔH(c) = -286 kJ - 1410 kJ + 2217 kJ = 521 kJ.
Ejemplo:

Si a la primera reacción le restamos la segunda nos queda la ecuación termoquímica problema:
ΔHR = ΔH(a) - ΔH(b) = -890 - (-283) = -607 kJ/mol
Obra publicada con Licencia Creative Commons Reconocimiento Compartir igual 4.0